
【香港商報网訊】長生生物狂犬病疫苗記錄造假事件引起廣泛關注,更在上周末掀起內地自媒體、朋友圈眾怒。一時間,國產疫苗質量安全問題再度成為輿論焦點。
涉嫌犯罪將追究刑責
昨日,國家藥監局對外通報長春長生生物科技有限責任公司違法違規生產凍乾人用狂犬病疫苗案件有關情況。
據國家藥監局負責人介紹,現已查明,企業編造生產記錄和產品檢驗記錄,隨意變更工藝參數和設備。上述行為嚴重違反了《中華人民共和國藥品管理法》《藥品生產質量管理規範》有關規定,國家藥監局已責令企業停止生產,收回藥品GMP證書,召回尚未使用的狂犬病疫苗。國家藥監局會同吉林省局已對企業立案調查,涉嫌犯罪的移送公安機關追究刑事責任。國家藥監局將組織對所有疫苗生產企業進行飛行檢查,對違反法律法規規定的行為要嚴肅查處。
國家藥監局還稱,該企業已上市銷售使用疫苗均經過法定檢驗,未發現質量問題。為進一步確認已上市疫苗的有效性,已啟動對企業留樣產品抽樣進行實驗室評估。
立案調查違法違規行為
7月5日,國家藥監局會根據舉報提供的線索,會同吉林省局對長春長生公司進行飛行檢查;7月15日,國家藥監局會同吉林省局組成調查組進駐企業全面開展調查,同時發布了《關於長春長生生物科技有限責任公司違法違規生產凍乾人用狂犬病疫苗的通告》,收回長春長生生物科技有限責任公司的《藥品GMP證書》,責令其停止狂犬疫苗的生產,並對相關違法違規行為立案調查。
然而,一波未平一波又起。長生生物日前再次發布公告,其全資子公司因生產的「百白破」疫苗「效價測定」項不符合規定,而收到《吉林省食品藥品監督管理局行政處罰決定書》,並被吉林食藥監管局合計罰款344萬餘人民幣元。此事已於去年10月立案調查。
長生康泰發布澄清公告
長生生物(002680.SZ)昨日關於深圳證券交易所關注函發布回覆公告稱,公司百白破生產車間已經停產,正積極研究百白破組份疫苗以及以此為基礎的多聯疫苗。對於此次事件的發生,感到十分的自責和愧疚。公司將引以為戒,舉一反三,制定切實可行的糾正措施,進行徹底整改,確保生產的合規性、真實性、可靠性、可追溯性以及疫苗質量的安全性。
而另一家被網文《疫苗之王》提及的深圳康泰生物製品有限公司(300601.SZ),在22日的公告中表示,《疫苗之王》一文因某疫苗企業生產記錄造假而質疑國產疫苗行業,文章多處不實,康泰生物與其他疫苗企業沒有股權關係和業務往來。公司與事件無關,經營有序,產品質量穩定,一切正常。
一眾官媒評論齊聲譴責
在疫苗事件持續發疇的過程中,監管自然也成為了質疑的焦點。多家官方媒體評論齊聲譴責。
《環球時報》社評稱,長春長生生物生產的疫苗涉嫌造假的事情這兩天在互聯網上刷屏,逐漸聚集起公眾的憤怒和恐慌,成為新的重大輿論事件。疫苗直接涉及兒童的健康,關乎生命,該領域的每一起負面新聞都會令全社會側目,監管好疫苗的安全生產堪稱是對國家現代治理能力的考驗。國家藥監部門應立即就上述問題回應公眾的關切。
《人民日報》則再一次提醒相關機構加強監管、提醒相關企業不要觸碰「紅線」。無論是生產企業還是監管部門,都必須以「敬畏生命」為信條,以更嚴格的生產標準、更嚴厲的常態監管、更嚴重的違法處罰規範行業發展,保住公眾對疫苗的信任。對於問題疫苗,發現一起查處一起很重要;但更重要的是在每次事件中找到問題的根源,否則就會陷於「亡羊補牢」的被動之中。
無獨有偶,新華視點同樣認為,對於疫苗可能造成的不良後果,相關部門有沒有做好應對措施?長生生物還有哪些疫苗可能存在隱患,背後有無利益輸送?這次事件對食藥監管理再次敲響警鐘,相關部門須一查到底!
孫咸澤十年任期離奇蹊蹺
值得注意的是,十年前轟動一時的三鹿奶粉事件中,被記過處分的國家藥監局食品安全協調司司長孫咸澤,後來仕途平穩,升任國家食品藥品監督管理總局副局長、藥品安全總監,疫苗安全正是他的工作重點。有分析稱,從新聞中可以看出他是直接主管疫苗的:2017年6月29日,時任食品藥品監管總局副局長的孫咸澤會見來訪的全球疫苗免疫聯盟首席執行官塞斯·伯克利博士一行,雙方就疫苗監管、中國疫苗參加世衛組織預認證及中國加入ICH後續工作等議題進行了交流;2017年10月10日,全國安全用藥月啟動儀式在京舉行。時任食品藥品監督管理總局副局長、藥品安全總監的孫咸澤出席啟動儀式並講話;2018年3月,孫咸澤雖然已轉任第十三屆全國政協教科衛體委員會副主任,離開國家藥監局,但是「百白破」疫苗事件爆發的時間恰恰是去年10月底,孫咸澤其時正在藥品安全總監的崗位上。
2008年,任食品安全司司長,奶粉出事;2017年,當藥品安全總監,疫苗出事。10年過去,歷史竟然如此離奇蹊蹺地走了一個輪回。
【事件延伸】舉報早已存在 或涉添加酶

昨日,《中國經營報》援引知情人士消息稱,此次被查所謂造假事件,主要涉及工藝變更中出現的添加?問題。且該人士透露,舉報則較早即已存在,由於該公司內部有區域分塊之間存在利益碰撞,舉報人確實是老職工,但也有其他身影。另據深交所2017年11月6日公布信息,長春長生批號為201605014-01的百白破聯合疫苗,在中檢院抽樣檢驗中,被檢出效價指標不符合標準規定。
武漢生物已售問題百白破40萬支
其實,同期被查出百白破疫苗有問題的不只長生生物一家。原國家食品藥品監管總局官網2017年11月3日發布的信息顯示,武漢生物製品研究所有限責任公司生產的批號為201607050-2的百白破疫苗效價指標也不符合標準規定。這些不合格產品當時就被立即停止使用。
武漢生物官網介紹,主導產品有吸附無細胞百白破聯合疫苗等,擁有年產7500萬劑量吸附無細胞百白破聯合疫苗生產基地。不過,經查,武漢生物生產上述不合格批次疫苗共計400520支,銷往重慶市疾病預防控制中心190520支,銷往河北省疾病預防控制中心210000支。
【事件外圍】省高院曾再審改判長生無罪
中國裁判文書網顯示,長春長生此前就曾涉入一起狂犬疫苗致患者殘疾民事訴訟案,整個訴訟過程超過十年。
2005年,山東省青州市一名男子被犬咬傷後,到衛生所注射狂犬疫苗,隨後其雙目幾近失明——二級殘疾。司法鑒定結果稱,其症狀與其注射狂犬疫苗存在關聯性。涉案疫苗由長春長生公司生產。2006年,該男子起訴涉事衛生所所屬公司——山東潤光液壓科技股份有限公司索賠。法院判決潤光公司賠償該男子共計約76.5萬元。
隨後,潤光公司起訴長春長生公司索賠。一審和二審法院均判決長春長生公司承担潤光公司經濟損失的80%(約61.2萬元),但再審法院山東省高級人民法院撤銷上述判決。長春長生公司最終沒有担責。判決書顯示,長春長生公司未能提供涉案疫苗(或所屬批次疫苗)的檢驗合格證明。司法鑒定顯示,症狀符合「罕見不良反應」特點,屬於「醫療意外」。
劉強東:提案政協嚴懲責任人
針對此次疫苗造假事件,京東集團創始人劉強東昨日發文稱,本次假疫苗事件,強烈建議相關政府部門嚴懲處理所有責任人,給公眾一個交代。他表示,他會向政協提案,會發動身邊的親人、朋友,會竭盡所能,在法律範圍內,討要一個說法。劉強東認為,本次假疫苗事件「比那些製造假阿迪、耐克的性質惡劣百倍!這些人不僅應該罰他個傾家蕩產,更應該施以重刑!」
【背景梳理】營收6成作銷售費 涉20起行賄案
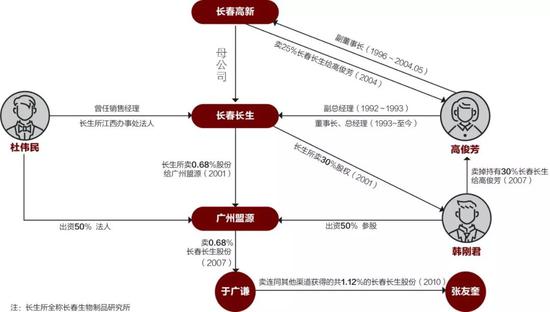
长春长生股权结构变迁记
長春生物年報顯示,2017年長生生物「疫苗銷售」的營業收入15.39億元,營業成本2.09億元,毛利率86.44%。但長春生物2.09億元的營業成本僅佔長生生物總成本的21.61%,60.27%用於銷售費用。財報顯示,4.42億元為「推廣服務費」,財報解釋為子公司長春長生向推廣服務公司支付的費用。然而,在疫苗銷售過程中,長春長生涉及多起行賄,其通過行賄地方醫院、疾病防疫部門,給予回扣方式推銷其產品。據第三方軟件統計,涉及長生生物的法律文書中,「貪污賄賂」類案件最多,為20例。年報顯示,長生生物2017年銷售費用為5.83億元,銷售人員僅25人,人均銷售費用2331.85萬元。
早在2002年,已有長春長生管理人員行賄行為相關案件。而在2017年11-12月,更是在短短一月之間,便共有5起行賄受賄案件涉及長生生物。就在去年,為提高品牌影響力,增加銷售份額,長生生物的推廣費由2016年的2.02億,激增至去年的4.42億元人民幣;會議費為7284萬元,同比增加2884%。
這或許是長生生物曾經連年漲價、各協會為其站台、山寨組織為其多款疫苗頒發「十大名牌產品」獎項的原因。
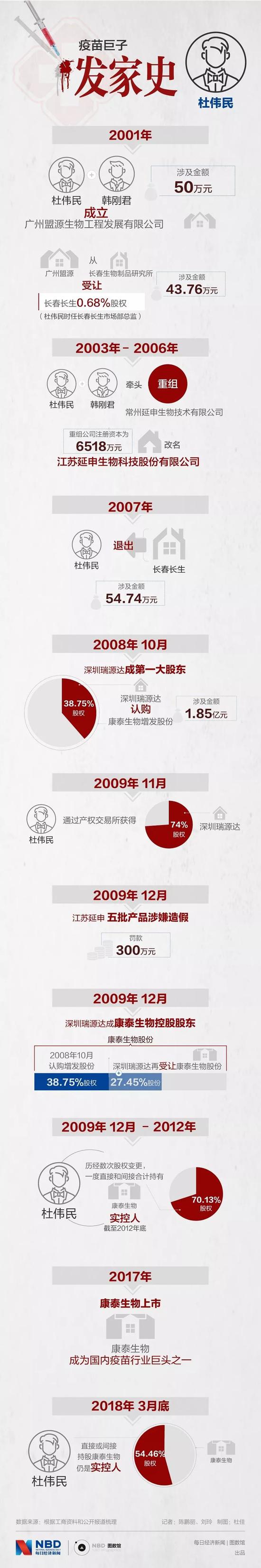
疫苗巨子·发家史


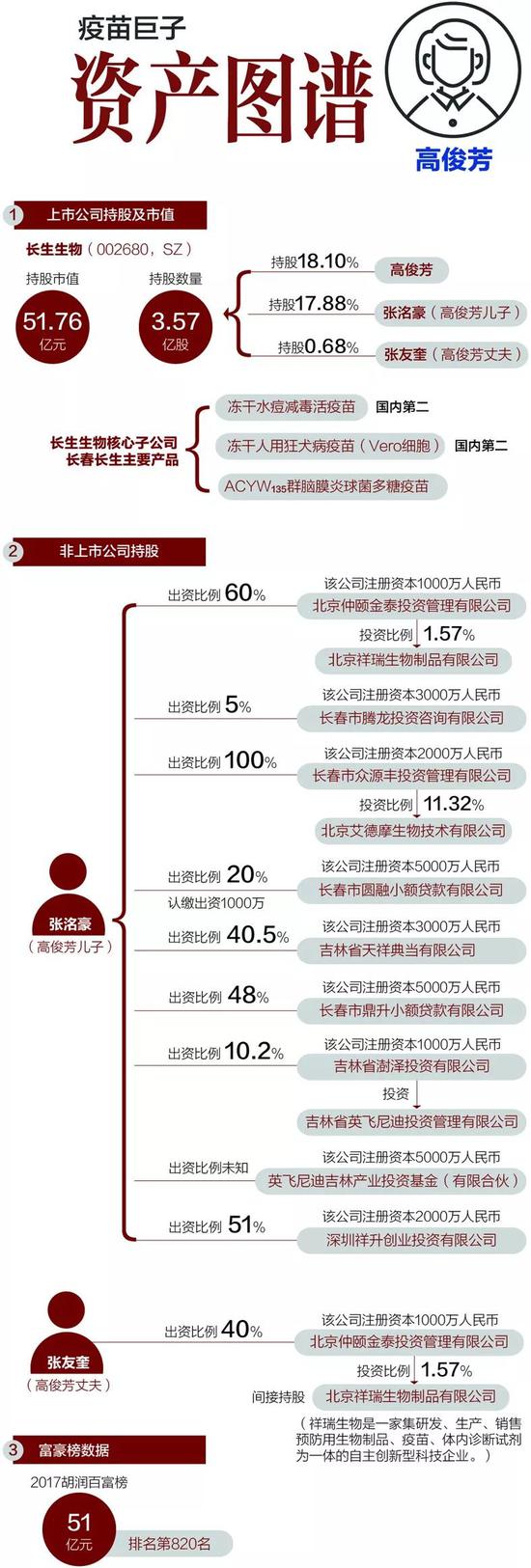
疫苗巨子·资产
毛利率超茅台
如此「營銷」收益不菲,據同花順數據,目前A股52家以疫苗為主營產品的上市公司,今年一季度銷售毛利率平均數高於50%,這一水平已經超過A股大部分行業。其中,此次事件主角長生生物(002680.SZ)91.59%的毛利率為行業首位,並超越同期貴州茅台(600519.SH)的毛利率(91.31%)。
【链接】國產降壓藥含致癌物 全球緊急召回
禍不單行,就在前幾天,美國環境保護機構(UnitedStatesEnvironmentalProtectionAgency)發現,部分抗高血壓成分纈沙坦(香港譯為「狄奧蔓」)中含有N-亞硝基二甲胺,這是一種對動物極危險的致癌物。加拿大、韓國、德國、西班牙、意大利等國家和香港、台灣地區相繼發布公告,召回含有某藥業提供的纈沙坦原料藥的製劑。各大外媒刷屏報道,矛頭直指中國製藥公司,歐洲藥品管理局EMA將這次事件稱為中國藥業醜聞。在當年震驚全國的「復旦投毒」事件中,犯罪嫌疑人使用的就是N-亞硝基二甲胺化合物。
據悉,冰島阿特維斯(actavis)藥廠此前將纈沙坦加工工作全權交給了中國浙江的製藥廠華海藥業,就在這款藥物大量流入市場之後,EMA對這款新藥實施了例行監測,結果顯示這批藥物中含有N-亞硝基二甲胺。隨後,EMA向美國環境保護機構申請協助檢測,結果同樣檢測出N-亞硝基二甲胺。據悉,華海藥業生產的纈沙坦原料藥主要銷往北美、歐洲、印度、俄羅斯和南美等市場,並未在中國大陸發售。上一年度,這家藥廠纈沙坦原料藥銷售金額為3.28億元人民幣。
目前,華海藥業承認在該藥生產過程中的未知雜質中,發現並檢定出了N-亞硝基二甲胺,該公司已經暫停纈沙坦生產。

