基因組編輯技術於生物醫藥研究領域日趨重要,更成為推動醫療創新的關鍵引擎。香港城市大學(城大)科研團隊早前獲中華人民共和國香港特別行政區政府「產學研 1+計劃」(RAISe+ Scheme)撥款資助,通過其先進的「DNA手術」科技,研發兩種新型基因治療藥物,分別應用於肝臟和心血管遺傳疾病,並計劃在未來三年將項目推進至臨床試驗階段。項目旨在為病患提供安全、高效及可負擔的一次性創新療法,進一步為香港以至全球的遺傳疾病患者帶來嶄新的治療希望。

今次獲資助項目由城大生物醫學科學系鄭宗立教授帶領,名為「治療遺傳性疾病的體內體細胞人類基因組編輯:將新型基因組編輯和工程交付載體轉化為臨床試驗」,旨在開發安全、有效且具特異性的基因組編輯技術。此技術將在第一階段臨床試驗中,對人類「體細胞(somatic cells)」進行測試。
然而,此療法的廣泛應用仍存在不少挑戰,尤其在用藥安全性、準確度和藥效持續性方面。目前約有 25%的遺傳疾病是來自「常染色體顯性遺傳」(意即繼承來自父或母任何一方的變異基因便足以引發病徵),而這些變異基因將持續產生有害蛋白質;但傳統的基因治療通常需要長期甚至終身服藥,效果亦會隨每次服藥後漸漸減弱,導致病情反覆。
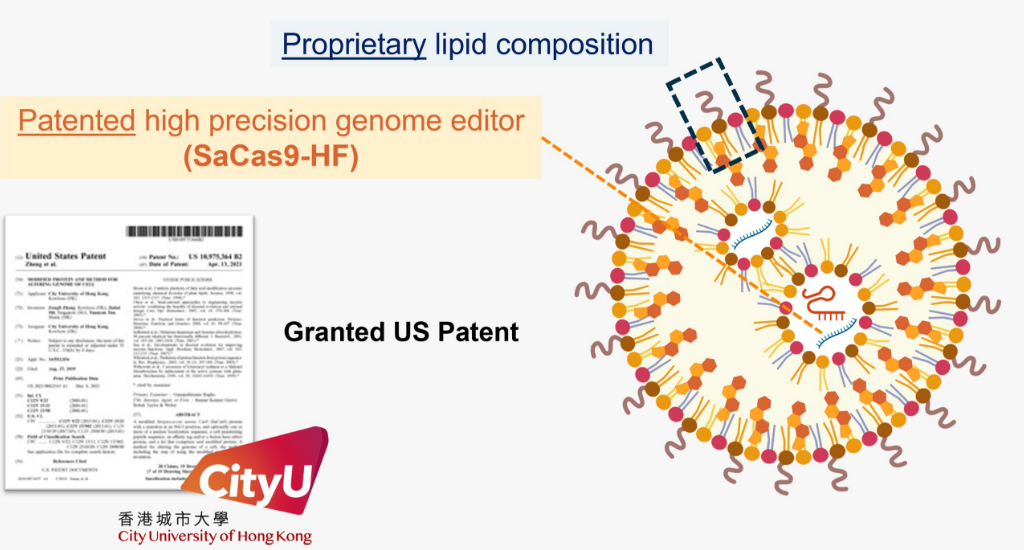
城大的科研團隊致力解決上述難題,利用曾獲諾貝爾獎的「CRISPR基因組編輯平台」,結合團隊研發的專利技術——高度精準的核酸酶(nucleases),再經由團隊改造的脂質納米顆粒(eLNPs)運送至目標細胞,為遺傳病患者進行體細胞變異的「DNA 手術」,同時提高了遞送經修復遺傳物質的效度及減少基因治療的「脫靶效應」(意即意外編輯非目標DNA)。此外,團隊也開發了一套專用的基因脫靶檢測系統,以更高靈敏度偵測脫靶效應。由於「DNA手術」可直接編輯體內的DNA,而修正後的DNA也可傳承至新生細胞,配合團隊的技術就可以提供一種長效持久的解決方案,消除重覆用藥的需要。
目前,團隊正開發兩款候選藥物,包括 PL-100——針對罕見肝臟遺傳疾病,以及 PL200——針對可為全球醫療帶來沉重負擔的心血管疾病。兩款候選藥物正準備進入新藥「IND支持性研究」以及由研發者發起之臨床試驗(investigator-initiated clinical trials)階段。
項目於非人類靈長類動物的初步臨床前研究經已完成,其精準的基因組編輯系統、高效的(基因藥)輸送載體可以帶來更低劑量的領先療效。未來,團隊將進行內部開發、或與藥廠等夥伴合作,從而將兩款新型候選藥物推進至臨床試驗階段。
圖源:城大供圖


